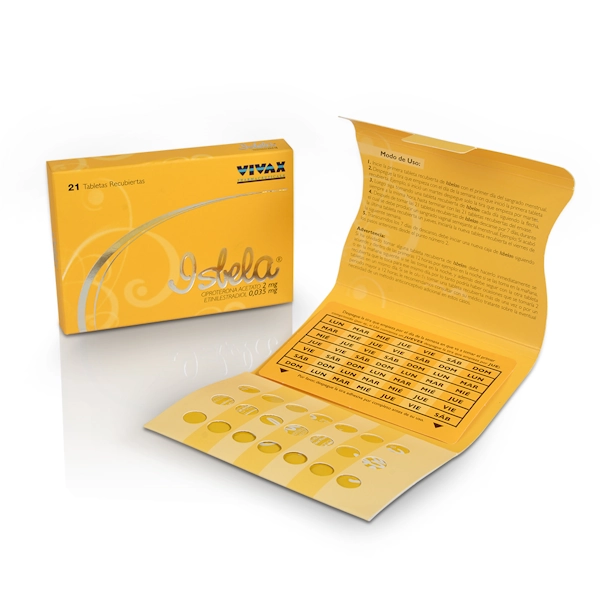
Descripción
VIA DE ADMINISTRACION
ORAL
PROPIEDADES FARMACOLOGICAS
Antiandrógenos. Ciproterona y estrógenos
Farmacodinamia
El acetato de ciproterona ejerce principalmente su actividad antiandrogénica bloqueando los receptores androgénicos. Además, ejerce una acción antigonadotrófica que reduce la síntesis de andrógenos. El etinilestradiol también contribuye aumentando los niveles de la globulina fijadora de hormonas sexuales (SHBG), por tanto, reduciendo los niveles de andrógenos libres en plasma. Adicionalmente, la combinación de acetato de ciproterona y etinilestradiol, ejerce su acción anticonceptiva hormonal esencialmente, mediante la inhibición de la ovulación y los cambios producidos en la secreción cervical.
Farmacocinética
Acetato de ciproterona
Absorción
Acetato de ciproterona administrado por vía oral se absorbe rápida y completamente. Aproximadamente 1,6 horas después de una administración única se alcanzan concentraciones plasmáticas máximas de 15 ng/mL. La biodisponibilidad es aproximadamente del 88%.
Distribución
Acetato de ciproterona se fija casi exclusivamente a la albúmina plasmática. Sólo el 3,5 – 4% de las concentraciones plasmáticas totales del fármaco están presentes como esteroide libre. El aumento de la SHBG inducido por el etinilestradiol no influye sobre la unión a proteínas plasmáticas de acetato de ciproterona. El volumen aparente de distribución de acetato de ciproterona es de aproximadamente 986 ± 437 L.
Biotransformación
Acetato de ciproterona es metabolizado casi completamente. El principal metabolito en plasma fue identificado como 15 hidroxi-acetato de ciproterona (15-OH-CPA), que se forma mediante la enzima CYP3A4 del sistema del citocromo P-450. La tasa de aclaramiento del plasma es de aproximadamente 3,6 mL/min/kg.
Eliminación
Los niveles plasmáticos de acetato de ciproterona disminuyen en dos fases que se caracterizan por vidas medias de aproximadamente 0,8 horas, y aproximadamente 2,3 – 3,3 días. Acetato de ciproterona se excreta parcialmente sin metabolizar. Sus metabolitos se excretan por vía urinaria y biliar en proporción aproximada de 1:2. La vida media de excreción de los metabolitos es de aproximadamente 1,8 días.
Estado de Equilibrio
La farmacocinética de acetato de ciproterona no está influida por los niveles de SHBG. Tras la administración diaria, los niveles plasmáticos del fármaco aumentan en aproximadamente 2,5 veces, alcanzando el estado de equilibrio durante la segunda mitad del ciclo de tratamiento.
Etinilestradiol
Absorción
Etinilestradiol administrado por vía oral se absorbe rápida y completamente. Se alcanzan concentraciones plasmáticas máximas de aproximadamente 71 pg/mL en 1,6 horas. Durante la absorción y primer paso hepático etinilestradiol es metabolizado extensamente, dando lugar a una biodisponibilidad oral media aproximada del 45% con una gran variación interindividual de aproximadamente el 20 – 65%
Distribución
Etinilestradiol se une en gran medida, pero no específicamente, a la albúmina plasmática (aproximadamente en un 98%), e induce un aumento en las concentraciones plasmáticas de SHBG. Se determinó un volumen aparente de distribución de aproximadamente 2,8 – 8,6 L/kg.
Biotransformación
Etinilestradiol sufre una conjugación presistémica en la mucosa del intestino delgado y el hígado. Etinilestradiol es metabolizado principalmente por hidroxilación aromática, pero se forman una gran variedad de metabolitos hidroxilados y metilados, y éstos aparecen como metabolitos libres y conjugados con glucurónidos y sulfatos. Se determinó una tasa de aclaramiento de aproximadamente 2,3 – 7 mL/min/kg.
Eliminación
Los niveles plasmáticos de etinilestradiol disminuyen en dos fases de disposición caracterizadas por vidas medias de aproximadamente 1 hora y de 10 – 20 horas respectivamente. El fármaco no se excreta sin metabolizar, siendo excretados los metabolitos de etinilestradiol por vía urinaria y biliar, en una proporción de 4:6. La vida media de excreción de los metabolitos es de aproximadamente 1 día.
Estado de Equilibrio
El estado de equilibrio se alcanza durante la segunda mitad del ciclo de tratamiento, cuando los niveles plasmáticos del fármaco, comparados con una dosis única, son superiores en un 60%.
Información preclínica sobre seguridad
Acetato de Ciproterona:
Los datos preclínicos no muestran un riesgo específico para los humanos basado en estudios convencionales de toxicidad a dosis repetidas en ratas, perros y monos. Las investigaciones sobre
la embriotoxicidad utilizando la combinación de los dos principios activos no mostraron efectos indicativos de un efecto teratogénico tras el tratamiento durante la organogénesis previa al desarrollo de los órganos genitales externos. La administración de acetato de ciproterona durante la fase de diferenciación hormono-sensible de los órganos genitales produce signos de feminización en fetos masculinos de rata tras dosis mayores. La observación de neonatos machos que sufrieron una exposición intrauterina a acetato de ciproterona no mostró ningún signo de feminización. Las pruebas de genotoxicidad mostraron que acetato de ciproterona produce aductos con el ADN y un aumento en la actividad reparadora del ADN en hepatocitos de ratas, monos y humanos (recién aislados). Los niveles de aductos con el ADN en hepatocitos de perro fueron extremadamente bajos. Esta formación de aductos con el ADN se produjo a los niveles de exposición sistémica que cabía esperar en los regímenes posológicos recomendados para acetato de ciproterona. En ratas tratadas con acetato de ciproterona se observó un aumento de la incidencia de lesiones hepáticas focales, posiblemente preneoplásicas, en las que las enzimas celulares estaban alteradas en ratas hembra, y un aumento de la frecuencia de mutaciones en ratas transgénicas. La experiencia clínica y los estudios epidemiológicos correctamente realizados hasta la fecha no apoyarían un aumento de la incidencia de tumores hepáticos en seres humanos. Las investigaciones realizadas sobre la tumorigenicidad de acetato de ciproterona en roedores tampoco revelaron ningún indicio de un potencial tumorígeno específico. Sin embargo, debe tenerse en cuenta que los esteroides sexuales pueden promover el crecimiento de ciertos tejidos y tumores hormono dependientes.
Etinilestradiol
Los datos preclínicos obtenidos en rata, ratones, perros y monos con el etinilestradiol en monoterapia no son predictivos de la situación en humanos tras su administración. No se observó potencial genotóxico de etinilestradiol en ensayos realizados in vitro e in vivo. No se han realizado estudios de carcinogenicidad en animales con la combinación de los dos principios activos.
INDICACIONES
- Anticonceptivo oral en el tratamiento de las enfermedades andrógeno-dependiente.
- Tratamiento del síndrome de ovario poliquístico.
POSOLOGIA
Dosis
Acetato de ciproterona 2 mg y etinilestradiol 35 mcg una vez al día por 21 días.
Dosis máxima:
El uso en exceso o más frecuente no genera beneficios terapéuticos adicionales y, por el contrario, podría ocasionar efectos adversos.
Dosis en poblaciones especiales:
Insuficiencia renal:
No se ha estudiado la asociación a dosis fija de ciproterona y etinilestradiol, en pacientes con alteración de la función renal. No hay datos disponibles que sugieran un cambio en el tratamiento, en esta población de pacientes.
Insuficiencia hepática:
Los trastornos agudos o crónicos de la función hepática requieren la suspensión del uso de acetato de ciproterona-etinilestradiol hasta que los marcadores de función hepática retornen a valores normales.
La recurrencia de una ictericia colestásica que apareció por primera vez durante un embarazo, o durante el uso previo de hormonas sexuales, requiere la suspensión de ciproterona – etinilestradiol.
Edad
El riesgo de aparición de un acontecimiento tromboembólico venoso, complicaciones tromboembólicas arteriales o un accidente cerebrovascular aumenta con la edad de la paciente.
Modo de empleo o forma de administración
Citrato de ciproterona-etinilestradiol inhibe la ovulación y, por tanto, actúa como anticonceptivo hormonal. Las pacientes que estén tomando ciproterona -etinilestradiol no deben usar un anticonceptivo hormonal adicional, ya que estaría expuesta a una dosis excesiva de hormonas. Se debe interrumpir la toma de anticonceptivos hormonales usados previamente. La forma de administración de ciproterona-etinilestradiol es similar a la forma de administración de otro anticonceptivo oral combinado. Por tanto, deben tenerse en cuenta las mismas normas de administración. La toma irregular de ciproterona- etinilestradiol puede provocar hemorragias intermenstruales y podría deteriorar su eficacia terapéutica y anticonceptiva. Los comprimidos deben tomarse en el orden indicado en el envase (blíster), cada día, aproximadamente a la misma hora, con algo de líquido si es necesario. Se tomará un comprimido diario durante 21 días consecutivos. Cada envase posterior se empezará después de un intervalo de 7 días libre de toma de comprimidos, durante el cual suele producirse una hemorragia por privación. Habitualmente ésta comienza en los días 2 – 3 después de la toma del último comprimido, y puede no haber terminado antes de empezar el siguiente envase. La toma de los comprimidos tiene que empezar en el día 1 del ciclo natural de la mujer (es decir, el primer día de su hemorragia menstrual). Si la paciente se retrasa menos de 12 horas en la toma de algún comprimido, debe tomar el comprimido tan pronto como se acuerde y debe seguir tomando los comprimidos siguientes a la hora habitual. Nunca se debe suspender la toma de comprimidos durante más de 7 días.
Duración de uso
El tiempo para que remitan los síntomas es de al menos tres meses. El médico debe valorar periódicamente la necesidad de mantener el tratamiento. Si se produce una recurrencia, semanas o meses después de la suspensión de la toma de los comprimidos, puede reanudarse el tratamiento. En caso del reinicio del tratamiento con la asociación a dosis fija de acetato de ciproterona 2 mg y etinilestradiol 35 mcg (tras un intervalo sin toma de comprimidos de al menos un mes) debe considerarse el aumento del riesgo de tromboembolismo venoso (TEV)
REACCIONES ADVERSAS
Las reacciones adversas se han clasificado por su frecuencia en:
– Muy frecuentes (>1/10)
– Frecuentes (>1/100, <1/10)
– Poco frecuentes (>1/1000, <1/100)
– Raras (>1/10.000, <1/1.000)
– Muy raras (<1/10.000)
– Frecuencia no conocida (notificadas durante uso post-comercialización y en datos de laboratorio)
Infecciones e infestaciones
Frecuentes:
Vaginitis, incluyendo candidiasis.
Trastornos del sistema inmunológico
Raras: Reacciones anafilácticas/anafilactoides, incluyendo casos muy raros de urticaria y reacciones graves con síntomas respiratorios y circulatorios.
Muy raras: Exacerbación del lupus eritematoso sistémico.
Frecuencia desconocida:
Exacerbación de los síntomas del angioedema hereditario y adquirido.
Trastornos del metabolismo y de la nutrición
Poco frecuentes: Cambios en el apetito (aumento o disminución).
Raras: Intolerancia a la glucosa.
Muy raras: Exacerbación de la porfiria.
Trastornos psiquiátricos
Frecuentes: Cambios de humor, incluyendo depresión, cambios en la libido
Trastornos del sistema nervioso
Muy frecuentes: Cefaleas incluyendo migrañas.
Frecuentes: Nerviosismo, vértigo.
Muy raras: Exacerbación de corea.
Trastornos oculares
Raras: Intolerancia a las lentes de contacto.
Muy raras: Neuritis óptica, trombosis vascular retinal.
Trastornos vasculares
Raras: Tromboembolismo.
Muy raras: Agravamiento de varices.
Frecuencia desconocida:
Aumento de la presión sanguínea.
Trastornos gastrointestinales
Frecuentes: Náuseas, vómitos, dolor abdominal.
Poco frecuentes: Cólicos, inflamación
Muy raras: Pancreatitis.
Trastornos hepatobiliares
Raras: Ictericia colestásica.
Muy raras: Colecistopatía incluyendo cálculos biliares, adenomas hepáticos, carcinoma hepatocelular.
Trastornos de la piel y del tejido subcutáneo
Poco frecuentes: Rash, cloasma que puede persistir.
Raras: Eritema nudoso.
Muy raras: Eritema multiforme.
Trastornos renales y urinarios
Muy raras: Síndrome hemolítico urémico.
Trastornos del aparato reproductor y de la mama
Muy frecuentes: Sangrados, manchados.
Frecuentes: Dolor mamario, tensión mamaria, aumento mamario, secreción mamaria, dismenorrea, cambios en el flujo menstrual, cambios en la secreción vaginal y ectropión cervical, amenorrea.
Trastornos generales y alteraciones en el lugar de administración
Frecuentes: Retención de líquidos, edema, cambios de peso (ganancia o pérdida).
Exploraciones complementarias
Poco frecuentes: Cambios en los niveles lipídicos séricos, incluyendo hipertrigliceridemia.
Raras: Disminución de los niveles séricos de folatos.
“Dada la importancia de mantener una supervisión continua de la relación beneficio/riesgo del medicamento, se invita los profesionales de la salud y a la comunidad en general a notificar cualquier sospecha de reacción adversa asociada a su uso al Centro Nacional de Vigilancia Farmacológica (CENAVIF) del Instituto Nacional de Higiene “Rafael Rangel”, a través de la página web: http://www.inhrr.gob.ve/ram1.php”.
INTERACCIONES
Con medicamentos, alimentos y bebidas
Las interacciones entre combinaciones de estrógenos/progestágenos, como ciproteronaetinilestradiol, y otros fármacos pueden dar lugar a un aumento del aclaramiento de las hormonas sexuales, lo que puede ocasionar hemorragia por privación y/o fallo terapéutico. La inducción enzimática ya se puede observar al cabo de unos pocos días de tratamiento. La inducción enzimática máxima se observa generalmente en unas pocas semanas. Tras la suspensión del tratamiento farmacológico, la inducción enzimática puede mantenerse durante aproximadamente 4 semanas.
Durante el tratamiento con cualquiera de estos fármacos, las mujeres deben utilizar temporalmente un método de barrera además de ciproterona-etinilestradiol, o elegir otro método de anticoncepción. El método de barrera debe utilizarse mientras dure la administración concomitante del fármaco, y durante los 28 días siguientes a su suspensión.
Si el periodo durante el cual se usa el método de barrera sobrepasa el final de los comprimidos del envase de ciproterona-etinilestradiol, se comenzará el siguiente envase sin respetar el intervalo usual libre de toma de comprimidos. La reducción de la concentración de etinilestradiol puede aumentar la incidencia de sangrado intermenstrual e irregularidades menstruales y reducir la eficacia del medicamento debido a:
Por reducción del tránsito intestinal
Antiácidos (principalmente los que contienen magnesio) y purgantes.
Por inducción del metabolismo (isoenzima 3A4 del citocromo P-450)
Anticonvulsivantes como: Hidantoínas (fenitoína), barbitúricos (fenobarbital), primidona, etosuximida, carbamazepina, oxcarbazepina, topiramato, felbamato.
Antituberculostáticos como: Rifampicina, rifabutina.
Otros: Griseofulvina, lansoprazol, modafinilo, Hypericum perforatum (hierba de San Juan). En el caso de este último el efecto inductor puede persistir durante al menos 2 semanas después de interrumpir el tratamiento con hierba de San Juan.
Sustancias con efectos variables sobre el aclaramiento de los AOCs
Muchos inhibidores de la proteasa del VIH y del virus de la hepatitis C y los inhibidores no nucleósidos de la transcriptasa pueden aumentar o disminuir las concentraciones plasmáticas de los estrógenos o de los progestágenos. Estos cambios pueden ser clínicamente relevantes en algunos casos.
Sustancias que disminuyen el aclaramiento de los AOCs
Atorvastatina.
Los inhibidores competitivos por sulfatación en la pared intestinal, tales como ácido ascórbico (vitamina C) y paracetamol.
Medicamentos que disminuyen el aclaramiento de AHC (inhibidores enzimáticos)
La relevancia clínica de las interacciones potenciales con inhibidores enzimáticos es aún desconocida. La administración concomitante de inhibidores potentes del CYP3A4 puede
aumentar las concentraciones plasmáticas del estrógeno, del progestágeno o de ambos. Se ha demostrado que dosis de etoricoxib de 60 a 120 mg/día aumentan las concentraciones plasmáticas del etinilestradiol de 1,4 a 1,6 veces respectivamente, cuando se toman conjuntamente con un anticonceptivo hormonal combinado con 0,035 mg de etinilestradiol.
Los medicamentos cuya acción puede modificarse por los anticonceptivos orales asociados
Anticoagulantes orales: los anticonceptivos orales (ACO) reducen el efecto de los anticoagulantes orales probablemente debido al efecto antagonista sobre algunos factores de la coagulación, sin embargo, potencian la acción del acenocumarol.
Los ACO reducen la tolerancia a la glucosa, dando lugar a una hiperglucemia y pudiendo restar eficacia a los antidiabéticos orales e insulina.
El etinilestradiol puede interferir en el metabolismo de otros fármacos por inhibición de las enzimas microsomales hepáticas o por inducción de la conjugación hepática de fármacos, particularmente glucuronización. De acuerdo a esto, la concentración en plasma y tejidos puede:
Incrementarse
– La administración concomitante con ACO con ciclosporina incrementa el riesgo de hepatotoxicidad.
– Los ACO incrementan el AUC y las concentraciones plasmáticas de metoprolol.
– Teofilina.
– Tizanidina
– Los ACO incrementan los niveles de las proteínas transportadoras de corticoides, elevándose la proporción de corticoides unidos a las mismas, retrasándose su eliminación y alargándose su vida media, con el peligro de potenciar sus efectos tóxicos.
– Se ha observado que el tratamiento concomitante con flunarizina y anticonceptivos orales incrementa el riesgo de galactorrea.
Disminuir
– El etinilestradiol puede reducir la intensidad y la duración del efecto analgésico del paracetamol y los salicilatos, así como el efecto de clofibratos y lamotrigina.
– Clofibratos.
– Lamotrigina.
Interacciones farmacodinámicas
El uso concomitante con medicamentos que contengan ombitasvir / paritaprevir / ritonavir y dasabuvir, con o sin ribavirina, o glecaprevir / pibrentasvir, puede aumentar el riesgo de elevaciones de ALT. Por tanto, las mujeres que tomen ciproterona- etinilestradiol deben cambiar a un método anticonceptivo alternativo (por ejemplo, los métodos anticonceptivos de progestágeno solo o métodos no hormonales) antes de iniciar el tratamiento con esta combinación de medicamentos. Ciproterona-etinilestradiol puede utilizarse 2 semanas después de la finalización del tratamiento con los fármacos antes citados.
Interferencia con pruebas de laboratorio
El uso de preparaciones como ciproterona-etinilestradiol pueden afectar los resultados de ciertas pruebas de laboratorio, entre ellos:
– Parámetros bioquímicos de función hepática (disminución de la bilirrubina y la fosfatasa alcalina), parámetros de la función tiroidea (aumento de T3 y T4 total debido a un aumento de TBG, reducción de la producción de resina T3 libre), función adrenal (aumento del cortisol en plasma, aumento del cortisol unido a globulina, reducción de la DHGA) y función renal (aumento de los niveles de creatinina).
– Los niveles plasmáticos de proteínas (transportadoras), p. ej., globulina fijadora de corticosteroides y fracciones lipídicas/lipoproteicas.
– Parámetros del metabolismo de los carbohidratos (la tolerancia a la glucosa puede verse disminuida) y parámetros de coagulación y fibrinólisis (aumento de protrombina y de los factores
VII, VIII, IX y X; aumento de la agregación plaquetaria inducida por norepinefrina).
– Disminución de la concentración de los folatos séricos. Esto debe ser considerado en mujeres que se embaraza al poco tiempo de interrumpir el tratamiento con anticonceptivos orales, siendo recomendable la toma de suplementos de ácido fólico antes de la concepción.
– Los cambios son leves y generalmente permanecen dentro de los límites normales. Debe informarse al laboratorio acerca de la utilización de anticonceptivos orales.
ADVERTENCIAS Y PRECAUCIONES
Generales
La administración de estrógenos y progestágenos está relacionada con una elevación del riesgo de sufrir enfermedades tromboembólicas. Por lo tanto, el comienzo de síntomas visuales o de cefalea grave debe considerarse como indicación para la suspensión del producto. Los anticonceptivos orales aumentan la frecuencia de aparición de colelitiasis. Si aparece un cuadro severo de depresión se deberá valorar la interrupción del tratamiento. Debe administrarse con precaución en los trastornos del metabolismo endocrino, depresiones psíquicas, pacientes diabéticos, pacientes epilépticos, jaqueca, asma, enfermedades cardiovasculares, anemia falciforme, insuficiencia renal.
En cirugía electiva, la administración de anticonceptivos orales debe suspenderse por lo menos un mes antes de toda intervención, para evitar un aumento del riesgo de trombosis postoperatoria.
Tumores:
El factor de riesgo más importante para el cáncer de cuello uterino es la infección persistente por el virus del papiloma humano (VPH). Algunos estudios epidemiológicos han indicado que el uso de AOCs a largo plazo puede contribuir más a este aumento de riesgo, pero sigue existiendo controversia acerca del grado en que este hallazgo es atribuible a otros factores de confusión, p.ej. las exploraciones cervicales y el comportamiento sexual, incluyendo el uso de anticonceptivos de barrera.
Existe un ligero incremento del riesgo relativo de presentar cáncer de mama diagnosticado en mujeres que están en tratamiento con AOC, en comparación con las que nunca los han tomado. El incremento de este riesgo desaparece gradualmente en el curso de los 10 años siguientes a la suspensión de los AOC. El cáncer de mama es raro en mujeres menores de 40 años y el exceso de diagnósticos de cáncer de mama en usuarias actuales y recientes de AOC es pequeño en relación con las no usuarias de AOC. El incremento del riesgo puede ser debido a un diagnóstico de cáncer de mama más precoz en usuarias de AOC, por estar sometidas a una vigilancia clínica más regular, a los efectos biológicos de los AOC o a una combinación de ambos. Por lo tanto, los cánceres de mama que se diagnostican en mujeres usuarias de AOC en alguna ocasión, tienden a estar menos avanzados clínicamente que los diagnosticados en las no usuarias de AOC.
Se ha observado un incremento leve del riesgo relativo de cáncer cervical y de neoplasia intraepitelial de cérvix. Dada la influencia biológica de los AOC sobre estas lesiones, se recomienda que, en caso de prescribir un AOC se hagan citologías cervicales periódicas.
Meningioma:
Se ha notificado la aparición de meningiomas (individuales y múltiples) asociados al uso de acetato de ciproterona, especialmente en dosis altas de 25 mg y superiores y durante un tiempo prolongado. Si a una paciente se le diagnostica meningioma, se debe interrumpir todo tratamiento que contenga ciproterona, como medida de precaución.
Embarazo
Embarazo La administración de ciproterona-etinilestradiol está contraindicada durante el embarazo. Si se produce un embarazo durante el tratamiento con ciproteronaetinilestradiol, la medicación debe suspenderse inmediatamente. Se han observado efectos adversos en fetos masculinos de rata tras la administración materna de acetato de ciproterona durante la fase de diferenciación hormono-sensible de los órganos genitales. No se administre durante el embarazo o cuando se sospeche su existencia.
Lactancia
La administración de ciproterona-etinilestradiol también está contraindicada durante el periodo de lactancia. El acetato de ciproterona puede pasar a la leche de las mujeres en periodo de lactancia. Aproximadamente el 0,2% de la dosis materna llegará al recién nacido a través de la leche, lo que corresponde a una dosis de aproximadamente 1 g/kg. Durante la lactancia establecida, el 0,02% de la dosis diaria materna de etinilestradiol puede llegar al recién nacido a través de la leche. En caso de ser imprescindible su uso por no existir otra alternativa terapéutica suspéndase la lactancia mientras dure el tratamiento.
CONTRAINDICACIONES
- Hipersensibilidad a cualquier componente de la formula.
- Uso concomitante de otro anticonceptivo hormonal.
- Presencia o antecedentes de trombosis, tromboembolismo, tromboflebitis.
- Insuficiencia vascular cerebral o coronaria.
- Enfermedades hepáticas y/o biliares.
- Carcinoma mamario y genital.
- Anemia de células falciformes.
- Diabetes mellitus con complicaciones vasculares.
- Neoplasias dependientes de estrógenos.
- Sangramiento genital de etiología desconocida.
- Salpingitis.
- Valvulopatías trombogénicas.
- Meningioma o antecedentes de meningioma.
- Embarazo y lactancia
SOBREDOSIS
Signos y síntomas
No se han notificado reacciones adversas graves por sobredosis con ciproteronaetinilestradiol. Los síntomas que pueden aparecer en este caso son: náuseas, vómitos y, en adolescentes, ligera hemorragia vaginal.
Tratamiento
No existe antídoto. El tratamiento debe ser sintomático.